Cell Res:复旦大学高强/樊嘉开发肝癌mRNA新抗原疫苗
来源:iNature 2025-12-03 10:59
该研究结果表明,AS是HCC现成mRNA疫苗的一个有希望的新抗原来源,并强调了克服抗原呈递障碍以进行有效免疫治疗的必要性。
肝细胞癌(HCC)仍然是一个主要的治疗挑战。虽然靶向肿瘤特异性抗原是癌症免疫治疗的基石,但目前的方法主要集中在突变衍生的新抗原上,这提供了有限的人群覆盖。
2025年11月28日,复旦大学高强及樊嘉共同通讯在Cell Research 在线发表题为Harnessing alternative splicing for off-the-shelf mRNA neoantigen vaccines in hepatocellular carcinoma的研究论文,该研究通过对279例HCC患者的多组学数据的综合分析,发现异常剪接(AS)事件发生的频率比体细胞突变高50-59倍,并且产生更多的免疫原性肽,具有更广泛的患者适用性(50.94% vs 4.40%的人群覆盖率)。
专注于AS转录本,该研究严格的筛选管道确定了34种新抗原,优先考虑强免疫原性,以开发有效的疫苗。体内概念验证实验证明了编码这些新抗原的mRNA疫苗的有效性,导致肿瘤显著消退,并增强肿瘤内新抗原反应性T细胞的浸润。该研究还通过提出使用TAP独立的AS衍生新抗原来规避免疫逃避,解决了HCC中转运蛋白相关抗原加工(TAP)缺陷的挑战。
总之,该研究结果表明,AS是HCC现成mRNA疫苗的一个有希望的新抗原来源,并强调了克服抗原呈递障碍以进行有效免疫治疗的必要性。

肝细胞癌(HCC)由于其高发病率和死亡率,对健康构成了重大挑战。癌症免疫治疗的最新进展,特别是免疫检查点抑制剂(ICIs),为HCC开辟了新的治疗途径。然而,ICI单药治疗实体肿瘤(包括HCC)的有效率仍然有限,通常在15%至30%之间。最近,CAR-T和TCR-T疗法对肝癌抗原如GPC3、HBsAg和AFP显示出了希望,但其有效性受到单靶点特异性和肿瘤异质性的限制。突变衍生的新抗原已被证明可以抑制肿瘤进展,并在肝癌、胰腺癌、结肠癌和多发性骨髓瘤中提供治疗益处。
然而,这些新抗原是高度个体化的,制备劳动密集,并且需要很长的开发周期。它们的有效性也仅限于具有高突变负担的肿瘤,限制了它们在更大人群中的适用性。识别具有更广泛人群覆盖范围和克服肿瘤异质性能力的肿瘤特异性新抗原可以提高癌症免疫治疗的疗效。
近年来,从非突变来源发现了许多潜在的新抗原,包括肿瘤特异性环状RNA,如circFAM53B,它可以通过翻译成隐肽触发特异性抗肿瘤反应。超过90%的人类基因经历RNA剪接,驱动跨组织和细胞类型的表型多样性,其变异与人类癌症的发展有关。在体内,RBM39降解剂胰岛素刺激肿瘤细胞中的异常剪接(AS),产生剪接衍生的免疫新表位,由主要组织相容性复合体(MHC)呈现,表明AS产生不依赖突变的肿瘤特异性新抗原。
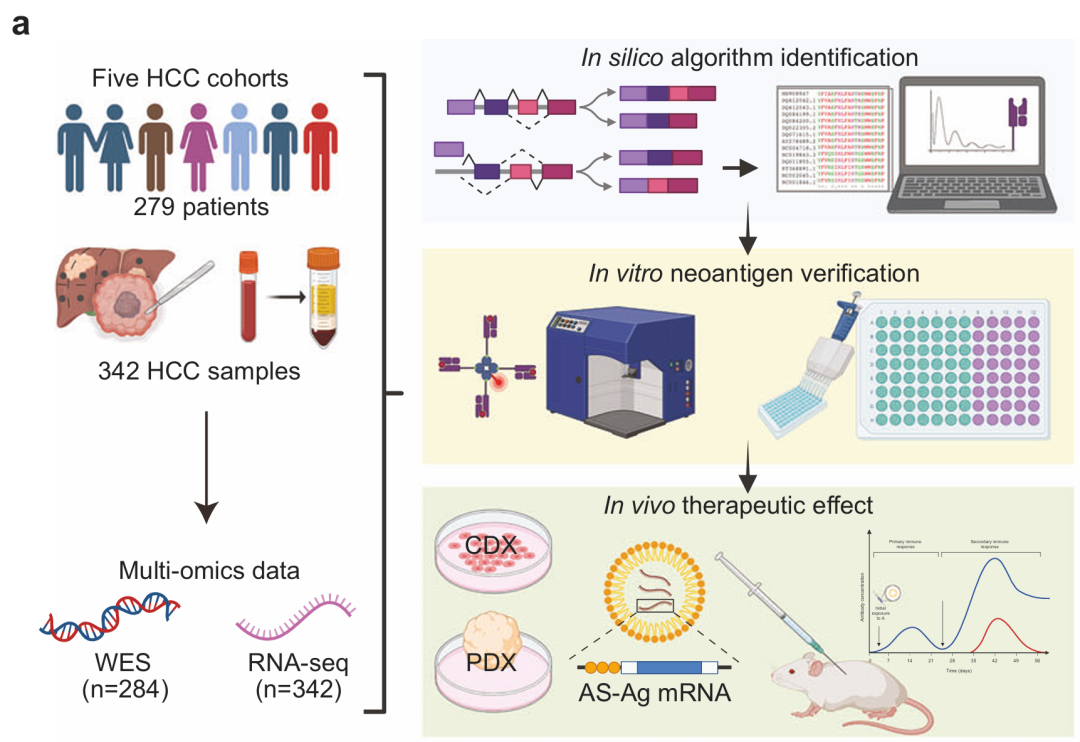
研究设计概述(图源自Cell Research )
许多用于AS预测的算法表明,剪接转录物可以翻译成含有MHC分子呈递的肽的肿瘤特异性蛋白,从而为癌症免疫治疗提供了新的靶点。此外,研究发现了由SRSF2突变诱导的CLK3和RHOT2错剪接事件产生的新抗原,并设计了具有特异性识别和细胞毒性的工程化T细胞受体(TCR),以抵抗SRSF2突变白血病。利用RNA测序(RNA-seq)数据可以很容易地鉴定AS衍生的新抗原,从而简化开发流程并最大限度地减少实验偏差。重要的是,AS衍生的新抗原(AS-NeoAgs)拥有大量潜在的免疫原性肽和广泛的人群覆盖。与突变衍生的新抗原不同,这些特征与广谱癌症免疫疗法的发展相一致。
高效抗原加工和递呈是抗肿瘤免疫级联的关键步骤。通过下调HLA -β2微球蛋白(B2M)或抗原表达缺失破坏这一机制的肿瘤通常对免疫治疗反应不佳。该研究发现HCC下调了与抗原加工相关的转运蛋白(TAP),从而损害了肽的装载和表面呈现。值得注意的是,某些肿瘤抗原可以通过TAP不依赖的非内质网(ER)途径呈递,使它们能够绕过TAP缺乏介导的免疫逃避。
该研究探索AS作为肝癌mRNA癌症疫苗免疫原性肽来源的潜力。通过全面分析人类HCC组织中的剪接事件,该研究确定了高覆盖率的AS新抗原,这些抗原克服了抗原呈递的挑战,并表现出有效的肿瘤抑制作用。这些发现将肿瘤特异性剪接定位为癌症免疫治疗中有价值的新抗原储存库,并强调了解决抗原呈递缺陷以提高mRNA疫苗在HCC中的疗效的重要性。
参考消息:
https://www.nature.com/articles/s41422-025-01199-0
版权声明 本网站所有注明“来源:生物谷”或“来源:bioon”的文字、图片和音视频资料,版权均属于生物谷网站所有。非经授权,任何媒体、网站或个人不得转载,否则将追究法律责任。取得书面授权转载时,须注明“来源:生物谷”。其它来源的文章系转载文章,本网所有转载文章系出于传递更多信息之目的,转载内容不代表本站立场。不希望被转载的媒体或个人可与我们联系,我们将立即进行删除处理。


